Värmekapacitiviteten (Specifik värmekapacitet) hos ett ämne kan beskrivas som den mängd energi som behövs för att värma upp ett kilo (kg) av ämnet en grad (°K eller °C).
– Värmekapacitiviteten, är en fysikalisk storhet och anger ett ämnes förmåga att lagra termisk energi. Storheten anges i joule/kg för att uppnå en temperaturförändring av en kelvin (°K) och har enheten [J/(kg*K)]. (I denna beräkning kan man använda grad Celsius °C istället för Kelvin °K eftersom det rör sig om differenser, ej absoluta tal.)
Värmekapacitiviteten är i stort sett konstant. Dock ändras Värmekapacitiviteten då materialet byter tillstånd. Exempelvis har vatten värdet 4,18 kJ/(kg·K) i flytande form och ungefär hälften i fast tillstånd (is eller ånga). Man kan tro att tyngre ämnen har högre värmekapacitivitet, men så är inte nödvändigtvis fallet
För att räkna ut hur mycket energi som går åt för att värma eller kyla så gäller följande formel:
Q = m * c * (T2-T1)
Q = värmemängd i joule (J)
m = massa i kilogram (kg)
c = specifik värmekapacitet i (kJ/kg*K)
T2 = sluttemperatur i kelvin (°K)
T1 = starttemperatur i kelvin (°K)
Värmekapacitiviteten hos några material
Ämne Cp [kJ/(kg·K)]
Järn 0,449
Vatten 4,181
Is 2,200
Ånga 1,97
Aluminium 0,897
Fisk 3,55
Kött, gris 2,84
Luft 1,004
Jag har självklart fler materials värden för värmekapacitivitet. Hör av er med vad ni söker?
Exempel:
Järn som väger 1 ton och temperaturen skall öka med 1000 °K.
Hur mycket energi måste då tillföras?
| 0,449 | kJ/kg*K |
| 1000 | kg |
| 1000 | °K |
| 449000 | kJ (för 1000kg till 1000 gr) |
| 125 | kWh (för 1000kg till 1000gr) |
Materialets tre aggregationstillstånd
Ett material kan inta tre olika tillstånd;
- Fast
- Flytande
- Gas
Förändring mellan fast till flytande form kallas smältning.
Förändring från flytande till gas form kallas förångning.
Dessa förändringar av tillstånd kräver extra energi (vid samma temperatur).
Vid smältning och stelning respektive förångning kondensering av ett material sker viss förändring av materialet samtidigt som temperaturen är konstant.
För vatten gäller följande vid smältning respektive förångning:
Smältning: Q = m * dhs, Förångning: Q = m * dhf
m = kg
dhs = specifik smältvärme i kJ/kg = 332 kJ/kg (inträder vid 0 C)
dhf = specifik ångbildningsvärme i kJ/kg = 2260 kJ/kg (inträder vid 100 C)
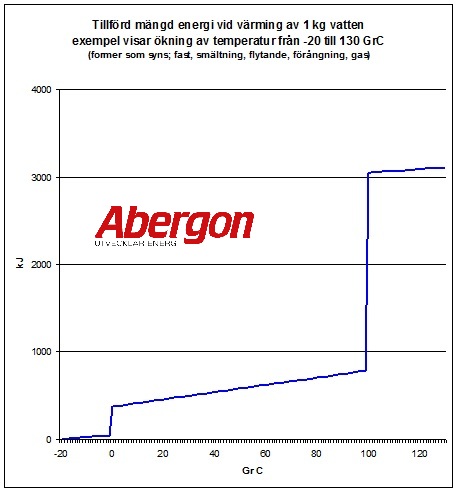
Nedan syns ett diagram för uppvärmning av 1 kg vatten från -20 GrC till 130 GrC och tillförd mängd energi. Obs se vad som händer vid fasförändringen.
Vill ni räkna om tex Joul till kWh prova då vår sida ”konverterare” genom att klicka på länken här